Väsentliga aspekter av MDR och patientsäkerhet vid upphandling av medicintekniska produkter
Sedan 2021 följs det europeiska regelverket MDR (Medical Device Regulation) noga inom medicintekniska branschen. MDR har som övergripande mål att säkerställa patientsäkerhet genom att upprätta och fastställa strikta krav på öppenhet, dokumentation, spårbarhet och uppföljning i samband med användningen av medicintekniska produkter.

Hur förhåller sig MDR till upphandling av medicintekniska produkter?
Det finns ett antal standarder, som är harmoniserade med MDR, som varje tillverkare med CE-märkning på sina produkter förväntas att följa. Dessa standarder inkluderar bland annat krav på biologisk utvärdering, kvalitetsledningssystem, riskhantering, märkning och elsäkerhet.
Vad MDR tydligt belyser är kravet på klinisk evidens. Det innebär att varje tillverkare måste redogöra för sina kliniska påståenden med underbyggande kliniska dokument och fakta. Att tillskriva sig egenskaper på en medicinteknisk produkt utan underbyggande evidens är enligt MDR strikt förbjudet. Till exempel, om en medicinteknisk produkt påstås kunna lindra smärta, måste det finnas kliniska bevis som inte bara bekräftar att produkten är ämnad för detta ändamål, utan även visar att den uppfyller sitt ändamål effektivt och säkert.
Enligt regelverket MDR, definieras klinisk evidens som: ”de kliniska data och resultat från kliniska utvärderingar som gäller en specifik produkt. Data som möjliggör en noggrann bedömning av produktens säkerhet och dess förmåga att uppnå de avsedda kliniska fördelarna när den används i enlighet med tillverkarens anvisningar”(1).
Kliniska bevis vid upphandling
För att säkerställa patientsäkerheten är det av avgörande vikt att upphandlande myndigheter, vid utvärderingen av medicintekniska produkter, har en klar insikt i de olika typer av bevis som underbygger tillverkarens påståenden om sina produkter. Ett kliniskt påstående angående en medicinteknisk produkt måste styrkas med kliniska data, vilket innebär att det krävs bevis som är baserade på användningen av produkten under en specificerad tidsperiod i dess avsedda användarmiljö och med dess avsedda användare. Detta är nödvändigt för att säkerställa att produkten uppfyller sina påstådda funktioner och är säker att använda i praktiken.
Evidensnivåer
Evidens klassificeras baserat på typ av kliniska data och dess kvalitet. Appendix III i MDCG 2020-06 visar förslag på hierarki av klinisk data för att visa överensstämmelse med de allmänna säkerhets och prestandakraven enligt MDR. Den högsta rangen i denna evidenshierarki innehas av högkvalitativa kliniska studier som täcker alla produktvarianter inklusive alla indikationer, patientgrupper, längd på behandling etc. som är tillverkarens avsedda ändamål. Därefter kommer högkvalitativa kliniska studier där begränsning görs till ett specifikt ändamål eller en specifik patientgrupp. Därefter följer högkvalitativa kliniska data från till exempel registerstudier och sedan följer utfall av kliniska studier där begränsning finns i metodik.
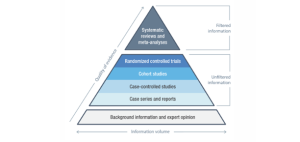
Stödjande bevis till kliniska påståenden kan också backas upp av ekvivalenta produkter där ekvivalens är påvisat och möter MDR kraven men är i sig otillräckliga som kliniska data för att bedöma överensstämmelse med de allmänna prestanda och säkerhetskraven på produkten. Säkerhetsövervakning, klagomål och proaktiv eftermarknadsuppföljning i form av enkäter, klassas som längre nivåer av kliniska data.
Längst ned i hierarkin finner vi tekniska tester (exempelvis kontrollerade tester på madrasser som enbart mäter tryckfördelning) och laboratoriestudier som utförs under kontrollerade laboratoriebetingelser. Dessa tester kan ge stödjande evidens och adressera kliniska effektmått, men är enligt MDR i sig otillräckliga som enskilda bevis för att bedöma den kliniska prestandan för att säkerställa att produkterna är säkra att använda i praktiken(2, 3).

Sammanfattningsvis, för att säkerställa uppfyllande av regelverket och därigenom patientsäkerheten är det avgörande att ställa krav på kliniska bevis för medicintekniska produkter som övervägs för upphandling. Förmågan att skilja mellan högkvalitativa kliniska data och stödjande data är centralt för att garantera att produkter som används inom sjukvården lever upp till de stränga kraven på patientsäkerhet och kvalitet som MDR föreskriver.
Referenser:
1. MDR 2017/745, Article 2. Hämtad 2023-12-01. https://eurlex.europa.eu/legalontent/EN/TXT/HTML/?uri=CELEX:32017R0745&from=IT
2. MDCG 2020-06, Regulation (EU) 2017/745: Clinical evidence needed for medical devices previously CE marked under Directives 93/42/EEC or 90/385/EEC A guide for manufacturers and notified bodies. Hämtad 2023-12-01. https://health.ec.europa.eu/system/files/2020-09/md_mdcg_2020_6_guidance_sufficient_clinical_evidence_en_0.pdf
3. Openmd. (2021) Levels of Evidence. Hämtad 2023-09-23. https://openmd.com/guide/levels-of-evidence

